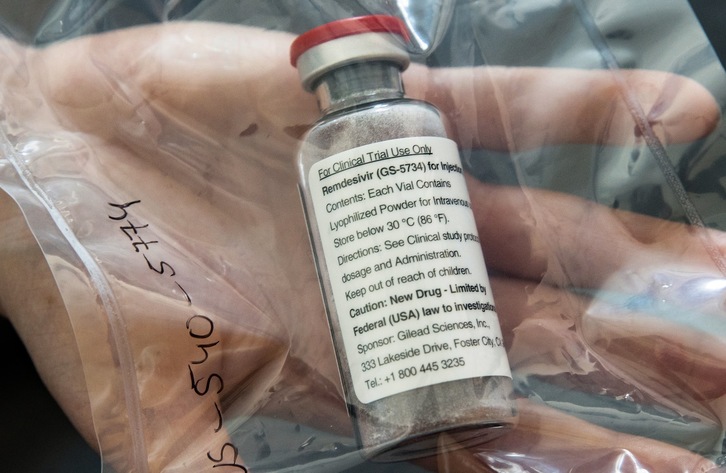
Remdesivir es un antiviral que ralentiza la producción de nuevas partículas de virus y, como resultado, una infección viral se desarrolla con menos rapidez y los pacientes en estado grave se recuperan una media de cuatro días antes de lo habitual.
El Gobierno estadounidense autorizó a comienzos del pasado mes de mayo el uso de este antiviral para tratar el covid-19, una decisión que no estuvo exenta de polémica, ya que el propio fabricante advirtió de que, había estudios que constataban entonces que su eficacia no estaba clara.
Aunque la última decisión está todavía en manos de la Comisión Europea, este es el primer medicamento que pasa la evaluación de la agencia médica, con sede en Ámsterdam, lo que se hizo «en un periodo excepcionalmente corto a través de un procedimiento de revisión continua», dada la emergencia de salud pública que supone el coronavirus.
La autorización «condicional» por parte de la EMA para vender un fármaco significa que este puede comercializarse con algo menos de datos disponibles y antes del tiempo habitual que lleva la autorización de un medicamento en condiciones normales, lo que facilita el acceso rápido al producto en contextos como una pandemia.
Este proceso de emergencia solo se sigue si el beneficio de la disponibilidad inmediata de un medicamento para los pacientes es superior al riesgo inherente al hecho de que aún no están disponibles todos los datos.
Esto se hizo incluso más rápido de lo esperado porque la calidad, los datos no clínicos y los clínicos preliminares, junto a la seguridad de este fármaco empezaron a ser estudiados por el comité de medicinas humanas de esta agencia el pasado 30 de abril, antes de que se presentara ante la EMA la solicitud de autorización de venta en la UE de Veklury, que llegó el 5 de junio.
El Remdesivir, una terapia experimental que empezó a desarrollarse en 2009 y se puso a prueba con pacientes del ébola a mediados de la década pasada, se ha autorizado para el coronavirus SARS-CoV-2 porque un ensayo clínico estadounidense mostró que ese fármaco acorta el tiempo de recuperación en algunos pacientes.
La evaluación del medicamento como un posible tratamiento de la COVID-19 en la UE ha concluido este jueves, principalmente en base a ese estudio del Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos (Niaid) en más de 1.000 pacientes críticos en 75 hospitales de diferentes países, y su efecto se comparó con un placebo y con el tiempo promedio que tarda en curarse un paciente de la COVID-19.
Los pacientes hospitalizados que tomaron Remdesivir se recuperaron un promedio de un 31% más rápido que los que tomaron placebo, mientras que el período medio de recuperación se redujo de 15 días a 11 días. Otros estudios señalan que su eficacia contra el nuevo coronavirus no está muy clara.
Teniendo en cuenta los datos disponibles, la Agencia considera que el balance entre beneficios y riesgos había demostrado ser positivo en pacientes con neumonía que requieren respiradores, los pacientes con enfermedad grave, por lo que ha optado por autorizarlo.
Está previsto que la Comisión Europea dé luz verde a este medicamento la próxima semana y se podrá comercializar en la UE bajo el nombre de Veklury durante un periodo de un año, aunque todavía no está claro cuántas dosis de Remdesivir estarán disponibles para el mercado europeo, lo que se tendrá que negociar con el productor estadounidense Gilead Sciences.

Expectación tras hallarse un planeta similar en tamaño y órbita a la Tierra

Pradales también rubricó el PGOU de Zaldibar por el que se imputa a la exalcaldesa de EH Bildu

Desconocidos roban la ikurriña de Ayuntamiento de Ondarroa y realizan pintadas
La adicción a la pregabalina no para de crecer en los márgenes

